
Kardiales Remodeling & Herzregeneration
Wissenschaftlich beschäftigt sich die Abteilung für Herzchirurgie sowohl mit klinischen als auch mit grundlagenwissenschaftlichen Themen. Auf dem Gebiet der Grundlagenforschung befasst sich die Arbeitsgruppe „Neue Biomarker im insuffizienten Herzen“ besonders mit den Themen kardiales Remodeling und Herzregeneration. Die Erforschung neuer Biomarker, die idealerweise auch als therapeutisches Target dienen können, bildet einen weiteren translatorischen Forschungsschwerpunkt der AG.
Rhythmuschirurgie
Im Fokus der Arbeitsgruppe „Rhythmuschirurgie“ stehen u.a. das Langzeit follow-up von CRT-Implantationen (Cardiac Resynchronization Therapy) bei Patienten mit Vorhofflimmern sowie die Behandlungsstrategien von Patienten mit infizierten Schrittmacher-und Defibrillatorsystemen.
Klinische Studien
Darüber hinaus nimmt die Abteilung für Herzchirurgie an mehreren klinischen Studien teil und kann auf ein umfangreiches Publikationsverzeichnis verweisen. Abgerundet wird die wissenschaftliche Arbeit durch die intensive Betreuung der Promovierenden.Einen ausführlichen Überblick über die Forschungsaktivitäten der Abteilung für Herzchirurgie finden Sie im Folgenden.
Kontakt
AG „Neue Biomarker im insuffizienten Herzen“
Prof. Dr. Manfred Richter
Benekestr. 2-8, 61231 Bad Nauheim
Tel.: +49 60 32. 9 96 2502
Fax.: +49 60 32. 9 96 2567
Kontakt
AG „Rhythmuschirurgie“
Priv.-Doz. Dr. med. Heiko Burger
Benekestr. 2-8, 61231 Bad Nauheim
Tel.: +49 60 32. 9 96 2502
Fax.: +49 60 32. 9 96 2567
Team AG „Neue Biomarker im insuffizienten Herzen“
Leitung AG "Neue Biomarker im insuffizienten Herzen"
Prof. Dr. Manfred Richter
Mitarbeitende AG "Neue Biomarker im insuffizienten Herzen"

Forschungsschwerpunkte AG „Neue Biomarker im insuffizienten Herzen“
Unsere interdisziplinäre Arbeitsgruppe "Neue Biomarker im insuffizienten Herzen" der Abteilung für Herzchirurgie (Direktor: Professor Dr. Yeong-Hoon Choi) verwendet in Zusammenarbeit mit dem Max-Planck-Institut in Bad Nauheim modernste Technologien mit dem Ziel, Forschungsergebnisse „vom Labortisch ans Krankenbett“ zu translatieren. Dabei ist neben der Suche und Identifikation von neuen Herzinsuffizienzmarkern sowohl im Herzmuskelgewebe als auch in der Zirkulation das Verstehen der Pathomechanismen, die zu einer Herzinsuffizienz führen, unser Forschungsschwerpunkt. Idealerweise sollte ein so identifizierter Biomarker nicht nur diagnostisch und prognostisch einsetzbar sein, sondern auch als therapeutisches Target dienen, um die Entwicklung einer Herzinsuffizienz zu verhindern oder umzukehren. Um diese Ansprüche erfolgreich umzusetzen, arbeitet unsere Arbeitsgruppe daher eng mit Experten der Grundlagen- und klinischen Forschung zusammen und integriert Doktoranden aus verschiedenen Fachbereichen. Mitglieder der Arbeitsgruppe sind: Prof. Dr. Manfred Richter (Leiter der AG), Dr. Praveen Gajawada, Dr. Ayse Cetinkaya. Technische Assistenz: Brigitte Matzke, Jutta Wetzel. Ein enger wissenschaftlicher Austausch besteht mit Mitarbeitenden des Max-Planck-Instituts für Herz- und Kreislaufforschung, mit dem Direktor der Abteilung für Herzchirurgie (Professor Dr. Yeong-Hoon Choi) sowie Prof. Dr. Markus Schönburg (Leiter Administration Forschung und Lehre) und Dr. Stefan Hein (Oberarzt der Abt. für Herzchirurgie). Im Folgenden finden Sie einige wichtige Projekte unserer Arbeitsgruppe.
- Der Einfluss von Reg3 Isoformen auf die Makrophagenmigration und Granulombildung im Zellkulturmodell und in Patienten mit kardialer Sarkoidose
- Die Funktion der Oncostatin M aktivierten Ras/Raf/MEK/Erk Signalkaskade (MAPK) in der Herzregeneration/Herzinsuffizienz und die kardiotoxische Wirkung von MAPK Inhibitoren in der Krebstherapie
- Die Rolle der extrazellulären Matrix der Kardiomyozyten und des Serums bei Herzerkrankungen von Kindern und Jugendlichen
- Funktionelle Charakterisierung der Rolle von Mast- und Immunzellen in der Entwicklung der Herzinsuffizienz von pädiatrischen Patienten
- Einfluss des Lipopeptids MALP-2 auf die myokardiale Funktion, Inflammation und Remodeling nach experimentellem Myokardinfarkt
- Kardio-Onkologie: Effekte von Sekreten der Kardiomyozyten auf Tumorzellen und umgekehrt die Einflüsse von Krebszellsekreten auf Muskelzellen
Forschungsbericht 2023 >
Projektbeschreibungen AG „Neue Biomarker im insuffizienten Herzen“
Project description english
Kardio-Onkologie: Die Wirkung klinisch eingesetzter MEK1/2-Inhibitoren (INH) auf Oncostatin M (OSM)-aktivierte Signalkaskaden und auf OSM-induzierte krebs- und herzinsuffizienzfördernde Sekretome
Die Interaktionen zwischen Muskel- und Krebszellen zu verstehen, ist von großer Bedeutung. Untersucht werden die Effekte von Sekreten der Kardiomyozyten auf Tumorzellen und umgekehrt die Einflüsse von Krebszellsekreten auf Muskelzellen. Durch umfassende Analysen in Zellkulturen und den Einsatz modernster Analyseverfahren, wie Transkriptom- und Proteomstudien, erhoffen wir uns, entscheidende Erkenntnisse zu gewinnen, die neue Wege für die Entwicklung von Therapien gegen Krebserkrankungen aufzeigen könnten. Es ist von zentraler Bedeutung, die spezifischen sezernierten Proteine und die Muster der intrazellulären Proteinphosphorylierung zu identifizieren, die für die Wirkungen von OSM und pharmakologischen Inhibitoren auf Muskel- und Krebszellen verantwortlich sind. Dieses Wissen ist nicht nur für das Verständnis der Mechanismen dieser Zytokine wichtig, sondern könnte auch den Weg für neue therapeutische Ansätze bei Krebs und verwandten Krankheiten ebnen.
[Projektpartner: Prof. Dr. Hakan Akintürk, JLU Gießen (Leiter der Kinderherzchirurgie), Dr. Ayse Cetinkaya, Funktionsoberärztin, Kerckhoff Klinik, Bad Nauheim, Prof. Dr. Rajkumar Savai, Institute for Lung Health (ILH), JLU Gießen und Dr. Andre Schneider, Max-Planck-Institut, Bad Nauheim.]
Kardiale Sarkoidose: Identifizierung von Biomarkern, die den Krankheitsverlauf anzeigen, und Klärung der komplexen Wechselwirkungen zwischen verschiedenen Immunzellsubtypen, Zytokinen und Signalwegen, die an der Entwicklung von Kardiale-Sarkoidose beteiligt sind.
Kardiale Sarkoidose ist eine entzündliche Erkrankung, die das Herz betrifft und zu unregelmäßigen Herzrhythmen oder sogar Herzversagen führen kann. Unser Forschungsteam führt eine Untersuchung der kardialen Sarkoidose in menschlichen Herzen durch. Durch die Analyse von Transkriptomen, die Anwendung von Immunfärbungstechniken und proteinbiochemischen Methoden streben wir danach, Schlüsselgene innerhalb der Granulome zu identifizieren. Diese Gene könnten Einblicke in dysfunktionale Signalübertragungswege und molekulare Muster bieten, die spezifisch für kardiale Sarkoidose sind. Unser Ziel ist es, Biomarker zu entdecken, die nicht nur das Fortschreiten der Erkrankung anzeigen, sondern auch potenzielle Anzeichen für eine positive Reaktion auf therapeutische Interventionen liefern könnten. Zusätzlich erforschen wir die komplexen Interaktionen zwischen verschiedenen Subgruppen von Immunzellen, Zytokinen und Signalwegen, um ein besseres Verständnis der Mechanismen zu erlangen, die zur Entstehung der kardialen Sarkoidose beitragen.
Funktionelle Charakterisierung der Rolle von Mast- und Immunzellen in der Entwicklung einer Herzinsuffizienz pädiatrischer Patienten
Die Immunzellinfiltration spielt sowohl in der Regeneration des Myokards nach akuter Schädigung als auch an der Entstehung der Herzinsuffizienz nach chronischer Entzündung eine entscheidende Rolle. Wir konnten in experimentellen Tiermodellen der Myokarditis und der dilatativen Kardiomyopathie (DCM) nachweisen, dass das zur Interleukin-6 Zytokinfamilie gehörende Oncostatin M (OSM) die Entstehung der Herzinsuffizienz durch den Abbau des O2-konsumierenden kontraktilen Apparates stark fördert. Weiterhin verstärkt OSM die Immunzellinfiltration durch Stimulation der Freisetzung von verschiedenen Chemokinen (biologische Lockstoffe) aus Kardiomyozyten (Reg3β). Unter den angelockten Immunzellen sind neben den Makrophagen die Mastzellen von besonderem Interesse, da sie bei Aktivierung hochgradig kardioaktive Zytokine wie OSM, TGFβ und Interleukin 4/13 (IL4/13) freisetzen. Während TGFβ Fibroblasten dazu veranlasst, extrazelluläre Matrixproteine abzusondern, was zur Fibrosierung beiträgt, potenzieren IL-4/13 die degenerative Wirkung von OSM auf den kontraktilen Apparat im entzündeten Myokard. Darüber hinaus können aktivierte Mastzellen im Herzmuskelgewebe multipotente Moleküle freisetzen, die die Funktionen verschiedener kardialer Zelltypen steuern.
Erste Ergebnisse zeigen, dass die myokardiale Infiltration von Mastzellen und Makrophagen bei den Herzerkrankungen pädiatrischer Patienten eine größere Rolle spielt als bei den Erwachsenen. Daher ist das Ziel dieses Projekts, die entzündliche Rolle dieser multifunktionalen Masterzelle im Kontext der Makrophageninfiltration zu klären, indem die DCM und die (Sub-)Aortenstenose von pädiatrischen Patienten mit denen von erwachsenen Patienten verglichen werden. Dabei werden modernste Mikroskopie- und Omics-Technologien eingesetzt, um das Ausmaß und die Funktion der Mastzelleninfiltration und anderer Immunzellen an der Entwicklung der Herzinsuffizienz von pädiatrischen Patienten zu klären.
[Projektpartner: Prof. Dr. Hakan Akintürk, JLU Gießen (Leiter der Kinderherzchirurgie) und Dr. Ayse Cetinkaya, Funktionsoberärztin, Kerckhoff Klinik, Bad Nauheim]
Einfluss des Lipopeptids MALP-2 auf die myokardiale Funktion, Inflammation und Remodelling nach experimentellem Myokardinfarkt
Die Rolle von macrophage-activating lipopeptide (MALP-2) als Ligand der Toll-like-Rezeptoren (TLR) in verschiedenen Modellen der vaskulären Regeneration wurde umfassend untersucht. TLRs sind nicht nur für die Regulierung inflammatorischer Prozesse bekannt, sondern auch für ihre Beteiligung an regenerativen Vorgängen, wie etwa der Bildung neuer Blutgefäße (Angiogenese). Dr. Grote von der Philipps-Universität Marburg erforscht seit vielen Jahren die adaptiven und regenerativen Effekte, die durch das MALP-2 vermittelt werden. Dieses bakterielle Lipopeptid, ursprünglich in Mycoplasma-Spezies entdeckt, wird von einem Heterodimer aus TLR2 und TLR6 auf der Zellmembran erkannt. Es wurde nachgewiesen, dass bereits eine einmalige Verabreichung von MALP-2 die Angiogenese, die Endothelregeneration nach Gefäßverletzungen sowie das vaskuläre Regenerationspotenzial mesenchymaler Stammzellen fördert. Studien haben gezeigt, dass die durch MALP-2 freigesetzten Wachstumsfaktoren aus Endothelzellen, insbesondere der granulocyte-macrophage colony-stimulating factor (GM-CSF), maßgeblich für diese regenerativen Effekte verantwortlich sind. Die Freisetzung von GM-CSF aus Endothelzellen wird dabei redox-sensitiv reguliert. Da MALP-2 die Angiogenese und Endothelregeneration fördert, könnte es eine wichtige Rolle bei der Wiederherstellung der Herzfunktion und der Verbesserung der Heilung nach einem Infarkt spielen. Darüber hinaus kann die Erforschung der molekularen Mechanismen, durch die MALP-2 wirkt, dazu beitragen, gezielte Behandlungen zu entwickeln.
[Projektpartner: Prof. Dr. Kerstin Troidl, TH Bingen und Max-Planck-Institut Bad Nauheim sowie PD. Dr. Karsten Grote, Philipps-Universität Marburg]
Die Funktion der Interleukin-4 Rezeptor Signalkaskade in der Oncostatin M gesteuerten Protektion und Degeneration von Kardiomyozyten
Der IL-4R wird als ein Schlüsselregulator zwischen humoraler und adaptiver Immunität betrachtet. Seine protektiven Eigenschaften nach Myokardinfarkt werden der Aktivierung und Vermehrung von Gewebsmakrophagen zugeschrieben. Unsere Studien zeigen jedoch klar, dass die Wirkungen des IL-4R nicht auf Makrophagen beschränkt sind. Der IL-4R vermittelt nicht nur anti-inflammatorische Signale seiner Liganden IL-4 und IL-13, sondern ist auch an der Oncostatin M Rezeptorsignalkaskade und am Kardiomyozytenremodelling beteiligt. Weiterhin zeigte sich in Herzmuskelzellkulturen ein viel breiteres Spektrum an Aktivitäten als erwartet, so dass dieser Rezeptor direkt im regulatorische Zentrum myokardialer Erkrankungen steht. Um die strukturelle, metabolische und inflammatorische Remodellierungskapazität der IL-4R Aktivierung zu bestimmen, wollen wir Herzmuskelzellkulturen mit und ohne Rezeptor bzw. Signalkomponenten (z.B. JAK/Stat; Ras/Raf/MEK/Erk) durch siRNA Knock-downs mit State-of-the-Art Techniken analysieren. Unser Forschungsprojekt soll in der Zellkultur klären, ob ein Targeting der IL-4R Kaskade das Potential hat, die Regeneration nach einem akuten Herzinfarkt zu verbessern und das Ausmaß der Degeneration von Herzmuskelzellen bei einer chronischen Herzerkrankung zu reduzieren.
Team AG "Rhythmuschirurgie"
Leitung AG "Rhythmuschirurgie"

Teammitglieder AG "Rhythmuschirurgie"



Kooperierende herzchirurgische Zentren
- UKE Hamburg / Prof. Dr. med. Simon Pecha
- St. Georg Hamburg / Priv.-Doz. Dr. med. Samer Hakmi
- MH Hannover / Prof. Dr. med. Christian Kühn
Forschungsschwerpunkte AG „Rhythmuschirurgie“
Jährlich werden deutschlandweit über 100.000 Herzschrittmacher- (HSM) und Defibrillatorsysteme (ICD) implantiert. Leider kommt es bei einzelnen Patienten während des Therapieverlaufs zu behandlungsbedürftigen Komplikationen. So werden jährlich etwa 20.000 Revisionseingriffe notwendig und die häufigste Ursache stellen Elektrodenprobleme dar. Aber auch Infektionen mit Beteiligung der implantierten Systeme repräsentieren mit etwa 8% einen relevanten Anteil und zeigen unbehandelt binnen eines Jahres eine Letalität von bis zu 60%. In dessen Kenntnis empfehlen die aktuellen Leitlinien (HRS, ESC) die umgehende Entfernung der infizierten Systeme.
- Analyse von drei differenten Behandlungsstrategien zur Behandlung infizierter Herzschrittmacher- und Defibrillatorsysteme
- Multizentrische GALLERY-Studie (GermAn Laser Lead Extraction RegistrY)
- Langzeit follow-up von CRT-Implantationen (Cardiac Resynchronization Therapy) bei Patienten mit Vorhofflimmern - Nutzen einer zusätzlich implantatierten Vorhofelektrode und Prognose einer Konversion in den Sinusrhythmus
- Multizenter Erfahrungen zum Einsatz einer tragbaren Cardioverter/Defibrillatorweste zum Schutz vor dem „Plötzlichen Herztod“ in einer herzchirurgischen Patientenkohorte
Forschungsbericht 2023 >
Projektbeschreibungen AG "Rhythmuschirurgie"
Analyse von drei differenten Behandlungsstrategien zur Behandlung infizierter Herzschrittmacher- und Defibrillatorsysteme
Jährlich werden deutschlandweit über 100.000 Herzschrittmacher- (HSM) und Defibrillatorsysteme (ICD) implantiert. Leider kommt es bei einzelnen Patienten während des Therapieverlaufs zu behandlungsbedürftigen Komplikationen. So werden jährlich etwa 20.000 Revisionseingriffe notwendig und die häufigste Ursache stellen Elektrodenprobleme dar.
Aber auch Infektionen mit Beteiligung der implantierten Systeme repräsentieren mit etwa 8% einen relevanten Anteil und zeigen unbehandelt binnen eines Jahres eine Letalität von bis zu 60%. In dessen Kenntnis empfehlen die aktuellen Leitlinien (HRS, ESC) die umgehende Entfernung der infizierten Systeme. Die Umsetzung dieser Therapieempfehlungen bereitet jedoch insbesondere bei Patienten Probleme, die keinen eigenen oder keinen ausreichenden Herzschlag aufweisen. In Kenntnis dieses Dilemmas beschreiben die aktuellen Leitlinien zur Sicherung der ventrikulären Stimulation die Möglichkeit zur Anlage einer epikardialen Ventrikelelektrode oder eines passageren „Opfersystems“. Während die epikardiale Elektrode sich außerhalb des Blutflusses und somit außerhalb des Infektionsfokus befindet, besteht das „Opfersystem“ aus einer transvenösen Schraubelektrode, die perkutan transvenös in die rechte Herzkammer nahe des Infektfokus eingebracht wird. Nach Ausheilung der Infektion wird diese dann wieder entfernt und durch eine dauerhafte Elektrode ersetzt, um Abklatschinfektionen zu vermeiden.
Grundsätzlich variiert das Ausmaß von Device-Infektionen aber erheblich. So finden sich Infektionsgeschehen unterschiedlicher Ausprägung, die zwischen lokalen und generalisierten Infektionen in Abhängigkeit von der Infektionslokalisation, den auslösenden Ursachen sowie dem verantwortlichen Keimspektrum schwanken.
Zuverlässige Zahlen zum Ausgang differenter Infektionsstrategien finden sich bisher leider nicht in der Literatur, weshalb dieses Thema mit Hilfe unserer Studie genauer beleuchtet werden sollte. Hierzu wurden 190 Patienten mit infizierten Systemen untersucht, die eine Systemextraktion erhielten. Hierunter fanden sich 89 nicht schrittmacherabhängige Patienten, die erst nach einer fremdkörperfreien Periode der Infektionsbehandlung ein neues System erhielten. Hingegen wurde 28 Patienten zum Zeitpunkt der Systementfernung eine epikardiale Elektrode zur Sicherung der Stimulation und 78 Patienten wurde zeitgleich zur Extraktion ein vollständig neues System kontralateral implantiert.
Anhand der Daten erhoffen wir uns Aussagen mit ausreichender Evidenz zum Langzeiterfolg der unterschiedlichen Behandlungskonzepte, um auf dessen Basis unser zukünftiges therapeutisches Vorgehen optimieren zu können.
Projektbeteiligte: Heiko Burger, Manfred Richter, Tibor Ziegelhöffer, Mona Strauß, Simon Pecha (Hamburg), Yeong-Hoon Choi

Multizentrische GALLERY-Studie (GermAn Laser Lead Extraction RegistrY)
Das retrospektive GALLERY-Register (GermAn Laser Lead Extraction RegistrY) untersuchte Laser-gestützte Elektrodenextraktionen von transvenösen Herzschrittmacher- bzw. Defibrillatorsonden an 23 Zentren. Betrachtet wurden hierbei alle behandelten Patienten im Zeitraum von 01/2013 bis 03/2017 und so handelte es sich um die deutschlandweit erste und weltweit größte Multizenterstudie zur Sicherheit und Effektivität von Laserextraktionen.
In das Register wurden insgesamt 2524 Patienten eingeschlossen bei denen 6117 Elektroden entfernt wurden (im Schnitt 2,18/Patient). Die entfernten Elektroden waren zudem mit durchschnittlich 96 Monaten Implantationsdauer deutlich älter als bei früheren Studien (LE-xICon 2010 oder ELECTRa 2017). Die klinisch prozedurale Erfolgsrate betrug 97,9% und die vollständige Sondenentfernung 94,9%. Weiterhin ergab sich eine Overall-Komplikationsrate von 4,3%, die sich in 2,1% major und 2,3% minor Komplikationen bei einer in-hospital Mortalität von 3,6% unterteilten.
Projektbeteiligte: Heiko Burger, Wolfgang Ehrlich
Studienpartner: Samer Hakmi und Simon Pecha (Universitäres Herzzentrum UKE, Hamburg)

Langzeit-follow-up von CRT-Implantationen (Cardiac Resynchronization Therapy) bei Patienten mit Vorhofflimmern - Nutzen einer zusätzlich implantatierten Vorhofelektrode und Prognose einer Konversion in den Sinusrhythmus
Zahlreiche Studien der letzten Jahre belegen, dass Patienten mit einer schweren Herzinsuffizienz von einer CRT (Cardiac Resynchronization Therapy) profitieren können. Diese Untersuchungen beziehen sich jedoch fast ausschließlich auf Patienten, die einen erhaltenen Sinusrhythmus aufweisen. Hingegen finden sich keine Untersuchungen zur Effektivität einer CRT bei Patienten mit Vorhofflimmern (VHF) bzw. welche Konversionsraten in den Sinusrhythmus unter einer CRT-Behandlung zu erwarten sind. Somit stellte sich uns die Frage, inwieweit die Implantation einer Vorhofelektrode bei bestehendem Vorhofflimmern während einer CRT-Implantation sinnvoll bzw. empfehlenswert ist und welcher Nutzen im Langzeit Follow-up durch diese Elektrode zu erwarten ist.
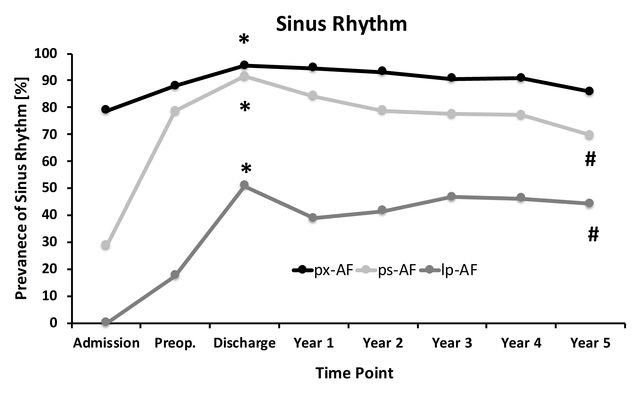
Um in dieser klinisch relevanten Fragestellung eine Evidenz basierte Entscheidungsgrundlage zu erlangen, wurden in dieser retrospektiven Patientenanalyse CRT-Systeme untersucht, die zwischen 2004 und 2018 in unserer Klinik implantiert wurden. Hierunter fanden sich 328 Patienten, die unter Vorhofflimmern litten. Diese wurden entsprechend ihrer Rhythmuser-krankung in drei Gruppen unterteilt (paroxysmales (px-AF), persistierendes (ps-AF) und langanhaltend-persistierendes Vorhofflimmern (lp-AF)) und anschließend genauer analysiert.
Im Rahmen der Eingriffe ereigneten sich im Zusammenhang mit der Elektrodenimplantation keine relevanten Komplikationen. Patienten mit px-AF zeigten zum Zeitpunkt der Aufnahme in 78,8% einen Sinusrhythmus (SR) und zu 95,5 % bei ihrer Entlassung. Nach 5 Jahren bestand noch in 85,7 % ein SR. Patienten, die unter persistierendem VHF (ps-AF) litten befanden sich zu 28,6 % während der Aufnahme im SR. Zur Entlassung waren es 91,4 % und nach fünf Jahren noch 69,7 %.
Hingegen befanden sich alle Patienten mit einem langanhaltendem-persistierendem VHF (lp-AF) zum Aufnahmezeitpunkt im VHF. Dieses konnte durch intensivierte Therapien im Verlauf der CRT-Implantation bis zur Entlassung zu 50,8 % in den SR konvertiert werden. Auch nach 5 Jahren waren in dieser Gruppe noch 44,1 % der Patienten im SR. Somit zeigte sich im Langzeitverlauf aller Gruppen eine unerwartet hohe Konversionsrate unter einer CRT in den Sinusrhythmus.
Daher empfehlen wir in der Abwägung zwischen der geringen Elektroden-assoziierten Komplikationsrate, der hohen Konversionsraten und der Invasivität einer zweizeitigen Vorhofsondenergänzung die Implantation einer atrialen Elektrode bei Patienten mit paroxysmalem und persistierendem Vorhofflimmern während einer de novo CRT-Implantation. Im Fall eines langanhaltend-persistierendem VHF raten wir hingegen zu einer umsichtigen Einzelfallentscheidung in Abwägung von existierenden Komorbiditäten und der zu erwartenden Wahrscheinlichkeit einer SR-Konversion.
Projektbeteiligte: Heiko Burger, Tibor Ziegelhöffer, Xenia Ackermann, Simon Pecha (Hamburg), Yeong-Hoon Choi
Multizenter Erfahrungen zum Einsatz einer tragbaren Cardioverter/Defibrillatorweste zum Schutz vor dem „Plötzlichen Herztod“ in einer herzchirurgischen Patientenkohorte
Der tragbare Kardioverter-Defibrillator (WCD) ist eine etablierte, sichere und wirksame Methode zum vorübergehenden Schutz von Patienten vor dem plötzlichen Herztod. In wie weit dies auch auf Patienten im unmittelbaren Anschluss an einen herzchirurgischen Eingriff zutrifft sollte in einer Multizenterstudie von 10 deutschen Zentren eingehender untersucht werden. Hierzu wurden in einer retrospektiven Studie 1168 Patienten analysiert, die zu 43% eine CABG, in 16% Klappenoperationen, zu 15% kombinierte CABG und Herzklappen-Operation und in 24% ICD-Explantation erhielten.
Hierbei kam es bei 9,1% der Patienten zu ventrikulären Tachykardien die zu 93,2% innerhalb der ersten 3 Monate nach der Herzoperation auftraten und zu 1,5% durch Schockabgaben terminiert werden mussten. Zu inadäquaten Schocks kam es in 0,7% der Fälle. Die LVEF der Patienten verbesserte sich während dieser Zeitspanne im Schnitt von 28% auf 35%, so dass eine ICD-Implantation letztlich nur noch bei 37% der Patienten notwendig wurde.
Projektbeteiligte: Heiko Burger, Andreas Hain






