Herzlich willkommen in der Abteilung für Thoraxchirurgie der Kerckhoff-Klinik!
In enger interdisziplinärer Kooperation mit lokalen und überregionalen Partnern und Spezialisten werden alle diagnostischen, minimalinvasiven und offen chirurgischen Eingriffe des thoraxchirurgischen Spektrums entsprechend neuester medizinischer Erkenntnisse auf höchstem Niveau angeboten. Für die chirurgische und interventionelle Behandlung der chronisch thromboembolischen pulmonalen Hypertonie (CTEPH) sind wir ein nationales und internationales Referenzzentrum. Zusammen mit unseren Partnerkliniken des Universitätsklinikums Gießen bilden wir das hessische Lungentransplantationszentrum.
Unser gemeinsam mit der Lungenklinik Waldhof-Elgershausen und dem Universitätsklinikum Gießen etabliertes Lungenkrebszentrum wurde 2017 von der Deutschen Krebsgesellschaft (DKG) zertifiziert.
Als akademische Einrichtung sind wir natürlich in Forschung und Lehre engagiert. In unserer Abteilung wird durch ein erfahrenes und kompetentes Pflege-, Physiotherapie- und Ärzteteam eine optimale Patientenversorgung in einer ansprechenden und menschlichen Atmosphäre gewährleistet.
Für Rückfragen stehen wir Ihnen gerne zur Verfügung.

Ihr Priv.-Doz. Dr. Stefan Guth und Team



Kontakt, Thoraxchirurgische Sprechstunde & Notfälle
Kerckhoff-Klinik GmbH
Lungenzentrum
Abteilung für Thoraxchirurgie
Priv.-Doz.Dr. Stefan Guth, Direktor der Abteilung
Benekestr. 2-8
61231 Bad Nauheim
Sekretariat
Frau Katja Schindler
Tel.: + 49 60 32. 9 96 24 02
Fax: + 49 60 32. 9 96 24 17
Anmeldung Patienten Lungenzentrum
Kontakt / Telefonnummern ausdrucken
Thoraxchirurgische Sprechstunde
Ludwigstr. 35
61231 Bad Nauheim
Anmeldung / Terminierungen über
Frau Sabine Jüttner
Tel.: +49 60 32. 9 96 24 86
Fax: +49 60 32. 9 96 24 78
Notfalleinweisungen
Sie erreichen den diensthabenden Arzt der Abt. f. Thoraxchirurgie über Tel.: + 49 60 32. 9 96 0 (Zentrale der Klinik)
INFORMATIONEN
Information für Ärzte
Liebe Kollegen,
Sie möchten uns einen Patienten ambulant oder stationär vorstellen?
Wir benötigen grundsätzlich:
- relevante schriftliche Vorbefunde (wenn vorhanden)
- aktuelle Laborwerte (wenn vorhanden)
- Medikamentenplan (wenn vorhanden)
- Überweisung eines nicht hausärztlich tätigen Facharztes/Ärztin, im
Lungenzentrum:
- Sprechstunde:Überweisung durch einen Facharzt/Ärztin für Lungenheilkunde (Pulmologie/Pneumologie) LANR: 30
- Stationäre Aufnahme: Einweisung (Verordnung von Krankenhausbehandlung)
Informationen zur Überweisung / LANR
Informationen für Patienten
Liebe Patienten,
bitte beachten Sie folgende Vorgaben, wenn Sie sich bei uns behandeln / untersuchen lassen möchten.
Gesetzlich versicherte Patienten (ambulant)
Untersuchungsmöglichkeiten nach Maßgabe der Kassenärztlichen Vereinigung: Für gesetzlich versicherte Patienten erfolgt die Behandlung bzw. Untersuchung im Rahmen Ihrer Krankenversicherung auf Überweisung durch Fachärzte, die nicht hausärztlich tätig sind. Im Lungenzentrum sind dies:
- Facharzt/Ärztin für Lungenheilkunde
- Facharzt/Ärztin für Onkologie
- Überweisungen von Fachärzten für Allgemeinmedizin (Hausärzte) sind für Ihre ambulante Behandlung/Untersuchung in der Kerckhoff-Klinik nicht gültig.
- Notfälle werden - wenn immer möglich - nach vorheriger telefonischer Anmeldung durch niedergelassene Allgemein- und Fachärzt:innen sowie Kliniken behandelt.
Wer darf überweisen? Hier finden Sie weitere Informationen
Privat versicherte Patienten (ambulant), Selbstzahler
Wenn Sie privat versichert sind, erfolgt die Anmeldung über die Sekretariate. Sollten Sie sich auf eigene Rechnung in unserer Klinik untersuchen und behandeln lassen wollen (Selbstzahler-Modus), bitten wir Sie, sich mit uns in Verbindung zu setzen.
Bitte bringen Sie vorhandene Voruntersuchungen (Rö-Aufnahmen, CT, MRT, Lungenfunktionsbefunde u.ä.) zu Ihrem Termin mit!
Aus organisatorischen Gründen ist eine offene Sprechstunde nicht möglich.
Leistungsspektrum
Unser operatives Spektrum umfasst alle modernen Verfahren der Thoraxchirurgie, besondere Schwerpunkte liegen bei minimalinvasiven Operationen (Thorakoskopie/VATS, Video-Mediastinoskopie, VATS-Lobektomie), erweiterten Lungenresektionen bei fortgeschrittenem Stadium des Lungenkrebs und bei lungengewebeerhaltenden Operationsverfahren (Manschettenresektionen). Bei der operativen Therapie von Lungenmetastasen kommt ein modernes Lasersystem zur Anwendung. Durch die Laserresektion ist eine gezielte Entfernung von Lungenmetastasen unter Schonung benachbarten Lungengewebes möglich.
Die pulmonale Endarteriektomie (PEA) bei chronisch thromboembolischer pulmonaler Hypertonie (thromboembolisch bedingter Lungenhochdruck, CTEPH, s. unten) wird regelmäßig (150 Operationen pro Jahr) und mit hoher Qualität (Sterblichkeitsrate seit 2016: 2 %) durchgeführt. Für inoperable CTEPH-Patienten wurde das katheterbasierte Verfahren der pulmonalen Ballonangioplastie (BPA) etabliert (> 250 Eingriffe im Jahr, Sterblichkeitsrate seit 2016: 0%; insgesamt <1%).
Die Lungentransplantation steht als chirurgische Option zur Behandlung des Endstadiums von Lungenerkrankungen zur Verfügung.
Operative Therapie bei bösartigen Erkrankungen des Brustraumes
- Minimalinvasive und offene Eingriffe bei Lungenkrebs (PDF)
- Lungenmetastasen anderer Tumore (PDF)
- Malignes Pleuramesotheliom (Rippenfellkrebs)
- Tumore des Mediastinums (Zwischenfellraum) (PDF)
- Tumore der Thoraxwand
- Tumore der Luftröhre
- Bösartige Ergüsse im Rippenfellraum oder Herzbeutel
Operative Therapie bei gutartigen Erkrankungen des Brustraumes
- Pneumothorax (Luftansammlung im Rippenfellraum)
- Gutartige Lungen- und Mediastinaltumoren
- Pleuraempyem (Rippenfellvereiterung)
- Gutartige Ergüsse im Rippenfellraum oder Herzbeutel
- Hämatothorax (Blutansammlung im Brustraum)
- Myasthenie (erworbene Muskelschwäche)
- Bronchial- oder Trachealstenose (Verengung der Luftröhre oder der Bronchien)
- Hyperhidrosis (vermehrte Schweissneigung der Hände und Achselhöhlen)
- Lungenvolumenreduktion bei Lungenemphysem
Diagnostische endoskopische und minimalinvasive Eingriffe
- Starre/ flexible Bronchoskopien (PDF)
- Endobronchialer Ultraschall (EBUS)
- Unklare Lungenrundherde
- Tumoren und Lymphknotenvergrößerungen im Mediastinum
- Rippenfell- und Brustwanderkrankungen
- Lungengerüsterkrankungen (z.B. Lungenfibrose)
Chronisch thromboembolische pulmonale Hypertonie (CTEPH)
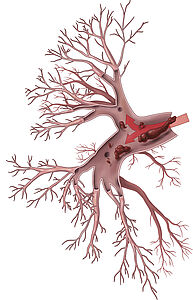
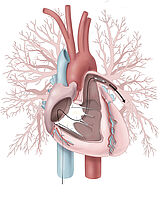
Die chronisch thromboembolische pulmonale Hypertonie (CTEPH) ist eine seltene, schwere Erkrankung der Lungenarterien und des rechten Herzens. Ursächlich sind Blutgerinnsel, die meist aus den Venen der unteren Körperhälfte, mit dem Blutstrom in die Lunge eingeschwemmt werden (= akute Lungenembolie) (Abb.1). Diese werden bei manchen Patienten zu Narbenmaterial umgebaut, das die Lungengefäße verlegt. In der Folge entsteht ein erhöhter Druck in den Lungenarterien (= pulmonale Hypertonie), was zu einer zunehmenden Belastung des rechten Herzens führt. Man geht heutzutage davon aus, dass bei bis zu 5 % der Patienten, die eine akute Lungenembolie überstehen, die Blutgerinnsel nicht aufgelöst werden, sondern zu Narben- oder Bindegewebe umgebaut werden und sich dann im weiteren Verlauf eine CTEPH entwickelt.
Symptome
Die meisten Patienten verspüren eine im Verlauf zunehmende Luftnot bei Belastung. Da die Beschwerden recht unspezifisch sind, vergehen zwischen dem Auftreten der ersten Symptome bis zur endgültigen Diagnosestellung durchschnittlich 14 Monate. Da sich viele Patienten dann in einem bereits fortgeschrittenen Krankheitsstadium befinden, sollte bei unklarer Atemnot, insbesondere nach stattgehabter Lungenembolie, eine zügige und exakte Diagnostik erfolgen, um die CTEPH nachzuweisen oder auszuschließen.
Diagnostik
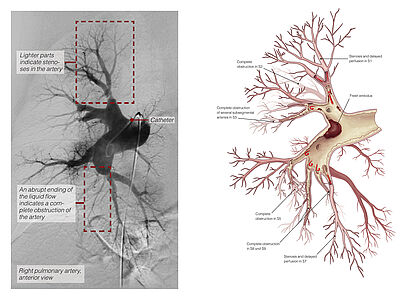
Zeichen der Rechtsherzbelastung im Herzultraschall (Echokardiografie) zusammen mit einem typischen Missverhältnis zwischen Belüftung und Durchblutung in der Lungenszintigrafie sollten Anlass sein, den Patienten in ein spezialisiertes CTEPH-Zentrum zu überweisen. Dort erfolgt neben weiteren bildgebenden Untersuchungen wie CT und Pulmonalis-Angiografie (Abb.2) auch der Rechtsherzkatheter, zur exakten Bestimmung der Schwere des Lungenhochdrucks. Die weitere Behandlung wird dann in einer wöchentlichen, interdisziplinären Konferenz festgelegt.
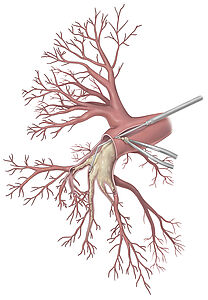
Operative Behandlung - pulmonale Endarteriektomie (PEA, früher PTE )
Ziel der PEA ist die Entfernung von Narbengewebe aus den Lungenschlagadern (Ausschälung der Lungenarterien) (Abb.3). Bereits seit den späten 1980er Jahren ist bei gegebener Operabilität die pulmonale Endarteriektomie (PEA) die Therapie der Wahl für Patienten mit CTEPH. Hierdurch kann in den allermeisten Fällen eine deutliche Besserung bis hin zur Heilung (Normalisierung des Drucks in den Lungenarterien) erzielt werden, wobei das Risiko des Eingriffes mittlerweile in spezialisierten Zentren niedrig ist. Insgesamt sind etwa zwei Drittel der Patienten operabel, wobei diese Beurteilung vor allem von der Erfahrung des behandelnden Zentrums abhängt: einerseits werden in weniger erfahrenen Zentren mehr Patienten als inoperabel eingestuft, andererseits ist auch die Sterblichkeit der PEA in weniger erfahrenen Zentren höher.
Mit >150 Operationen pro Jahr verfügt die Kerckhoff-Klinik über eines der vier größten PEA-Programme weltweit. Die Gesamtsterblichkeit beträgt nur noch ca. 2 %, wobei das Risiko des einzelnen Patienten aufgrund der Schwere der Erkrankung und der Verteilung der Gefäßverschlüsse variieren kann. Eine entsprechende Einschätzung erhält jeder unserer Patienten vor der Operation.
Der Eingriff wird in Allgemeinnarkose durchgeführt. Zur Freilegung des Herzens wird das Brustbein längs eröffnet. Die Tätigkeit von Herz und Lungen wird dann von einer Herz-Lungen-Maschine übernommen. Hierfür wird das Blut aus den großen herznahen Venen abgenommen und nach Aufsättigung mit Sauerstoff in die Hauptschlagader zurückgeleitet. Zudem wird der Patient durch Erniedrigung der Bluttemperatur auf 18 °C abgekühlt. Dieser Schritt ist notwendig, um die Durchblutung des Körpers für die Zeit der Ausschälung der Lungenarterien zu stoppen. Die Lunge verfügt über eine besondere Gefäßversorgung mit zusätzlichen Gefäßen aus der Körperschlagader zur Versorgung der Lungenzellen. Würde man die Durchblutung nicht unterbinden, wäre die Sicht des Operateurs stark eingeschränkt und damit eine Verletzung der Lungengefäße möglich. Nach Entfernung des Narbenmaterials beginnt die Wiedererwärmung auf 36 °C. Nach Abgang von der Herz-Lungen-Maschine und Kontrolle des OP-Feldes werden die Brustbeinhälften durch Drähte aneinandergefügt, die dort verbleiben und im Allgemeinen keine Störungen oder Beschwerden verursachen. Nach der Operation erfolgt die Verlegung auf die Intensivstation, wo Herztätigkeit, Kreislauf und Flüssigkeitshaushalt überwacht sowie durch Infusionen und Medikamente stabilisiert werden. Die meisten Patienten werden am zweiten Tag nach der Operation auf die Normalstation verlegt. Nach Entfernen der Wunddrainagen wird mit einer zeitlebens fortzuführenden Blutverdünnung begonnen. Nach insgesamt ca. 12 Tagen wird der Patient wieder nach Hause entlassen. Wir empfehlen und organisieren gerne für jeden Patienten eine anschließende Rehabilitationsmaßnahme in spezialisierten Kliniken.
Nach einem Jahr sollte eine Nachkontrolle inklusive einer Rechtsherzkatheteruntersuchung erfolgen. Bis dahin übernimmt die Nachsorge ein auf Lungenhochdruck spezialisierter Internist. Die Anbindung an eine Schwerpunkt-Ambulanz ist zu empfehlen.
Pulmonale Ballonangioplastie (BPA)
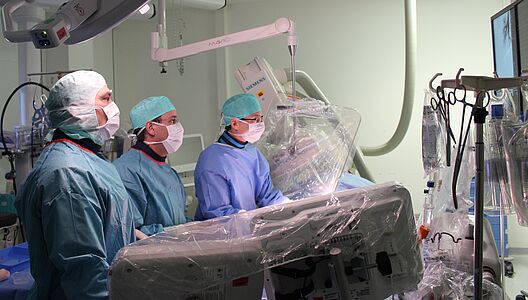
Seit der ersten Beschreibung in 1988 wurde die pulmonale Ballonangioplastie (BPA) anfangs nur sehr selten durchgeführt. Seit etwa 2010 haben verschiedene Arbeitsgruppen vor allem aus Japan Erfahrungen mit größeren Patientengruppen gesammelt. Seit März 2014 wird dieser spezielle Eingriff auch in der Kerckhoff-Klinik angeboten. Mittlerweile gehört unsere Abteilung zu den größten BPA-Zentren weltweit. Alle Patienten werden dabei durch ein erfahrenes und speziell-geschultes BPA-Team betreut (Abb. 4).
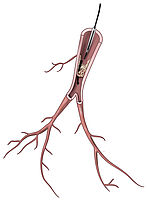
Mit Hilfe der BPA können weit peripher gelegene Veränderungen der Pulmonalarterien mittels eines Führungsdrahtes erreicht und anschließend mit einem Ballon aufgedehnt werden. Jedoch können dabei, in Abhängigkeit von der Schwere der Erkrankung, nur wenige Läsionen auf einmal behandelt werden. Es sind daher mehrere Sitzungen erforderlich.
Die BPA wird am wachen Patienten durchgeführt. Über einen venösen Zugang in der Leiste wird eine Schleuse eingebracht, über die dann Führungskatheter und –drähte vorgeschoben werden (Abb. 5).
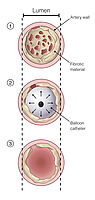
Entsprechend der vorab festgelegten Zielgebiete werden die jeweiligen Segmentarterien mit einem Draht sondiert (Abb. 6) und anschließend die Veränderungen mit speziellen Ballons aufgedehnt. Hierdurch kommt es zu einer Zerreißung narbiger Fasern, die das Lungengefäß zuvor eingeengt oder verlegt hatten (Abb. 7).
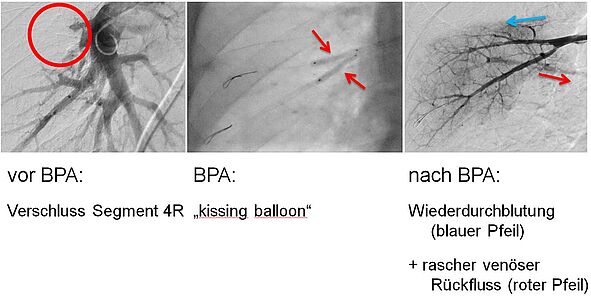
Durch die BPA verbessert sich die Durchblutung des Lungengewebes. Hierdurch verbessern sich Lungenhochdruck, Sauerstoffaufnahme ins Blut und Belastung des rechten Herzens. Dadurch nimmt die körperliche Belastbarkeit des Patienten deutlich zu (Abb. 8).
Gezielte, medikamentöse Therapie
Patienten mit inoperabler CTEPH werden medikamentös behandelt. Mittlerweile steht mit Riociguat die erste hierfür zugelassene Substanz zur Verfügung. Klinisch konnte hierdurch eine deutliche Reduktion des Lungengefäßwiderstandes sowie eine Verlängerung der 6-Minuten-Gehstrecke beobachtet werden. Diese Therapie wurde federführend durch Herrn Prof. Dr. H.-A. Ghofrani (Direktor der Abteilung allgemeine Pneumologie, Kerckhoff-Klinik) entwickelt, wofür er den Deutschen Zukunftspreis des Bundespräsidenten in 2015 erhalten hat.
Stationen
Auf der thoraxchirurgischen / pneumologischen Station und den Intensivstationen werden jährlich mehr als 1500 Patienten mit Lungenerkrankungen stationär versorgt. Dafür stehen auf der Station Beneke 33 Planbetten zur Verfügung. Die Station Beneke finden Sie in Gebäude B der Klinik.
- Station Beneke, Gebäude B, 3. Stock
Tel.: + 49 60 32. 9 96 61 96 oder 21 95
Fax: + 49 60 32. 9 96 21 97
Informationen zu unseren Wahlleistungen finden Sie hier >>
- Intensivstationen, Gebäude B / Z / K, 2. Stock
Unsere engagierten und hervorragend ausgebildeten Mitarbeitenden sorgen für die bestmögliche Versorgung und Betreuung der Patienten. Die Kooperation der verschiedenen Berufsgruppen wie Pflege, ärztlicher und medizinisch-technischer Dienst zeichnet uns allgemein und besonders auch auf den Stationen aus. Dahinter steht die Erkenntnis, dass nur das Miteinander von Pflege und Medizin, von Technik und persönlicher Zuwendung zu einer optimalen und patientengerechten Versorgung führt.
Das Team
Direktor & Sekretariat
Priv.-Doz. Dr. Stefan Guth
Tel.: + 49 (0) 6032 996 2402
Fax: + 49 (0) 6032 996 2417
Sekretariat
Frau Katja Schindler
Tel.: + 49 (0) 6032 996 2402
Fax: + 49 (0) 6032 996 2417
Geschäftsführender Oberarzt
Priv.-Doz. Dr. Diethard Prüfer
Tel.: + 49 (0) 6032 996 2402
Fax: + 49 (0) 6032 996 2417
Sekretariat
Thoraxchirurgische Sprechstunde
Anmeldung / Terminierungen über
Frau Sabine Jüttner
Tel.: +49 60 32. 9 96 24 86
Fax: +49 60 32. 9 96 24 78
Sektionsleiter Interventionelle Therapie der CTEPH

Priv.-Doz. Dr. Christoph B. Wiedenroth
Tel.: + 49 (0) 6032 996 2402
Fax: + 49 (0) 6032 996 2417
E-Mail: c.wiedenroth@kerckhoff-klinik.de
Oberärzte
Assistenzärzte
Weiterbildung & Stellenausschreibungen
Weiterbildungsermächtigungen für
1. Basisweiterbildung Chirurgie (24 Monate)
2. Weiterbildung FA Thoraxchirurgie (48 Monate)
Forschung
Veröffentlichungen 2020 - Mai 2021
- Wiedenroth, C.B., S. Guth, S.D. Kriechbaum, A. Breithecker, and C. Liebetrau, Balloon pulmonary angioplasty in the treatment of chronic thromboembolic pulmonary hypertension: recent advances and future perspectives. Kardiol Pol, 2021. 79(2): p. 123-128.
- Triantafyllidi, H., A. Mpahara, M. Mademli, and E. Mayer, Chronic thromboembolic pulmonary hypertension due to an implantable cardioverter-defibrillator's lead thrombosis. Hellenic J Cardiol, 2021.
- Nagel, C., N. Benjamin, B. Egenlauf, C.A. Eichstaedt, C. Fischer, E. Paleviciute, J. Celutkiene, S. Harutyunova, E. Mayer, M. Nasereddin, A.M. Marra, E. Grunig, and S. Guth, Effect of Supervised Training Therapy on Pulmonary Arterial Compliance and Stroke Volume in Severe Pulmonary Arterial Hypertension and Inoperable or Persistent Chronic Thromboembolic Pulmonary Hypertension. Respiration, 2021. 100(5): p. 369-378.
- Kovacs, Z., S. Guth, D. Fistera, C. Taube, and C.B. Wiedenroth, [Congenital Pulmonary Artery Stenoses as a Rare Cause of Pulmonary Hypertension]. Pneumologie, 2021.
- Keranov, S., O. Dorr, L. Jafari, C. Troidl, C. Liebetrau, S. Kriechbaum, T. Keller, S. Voss, T. Bauer, J. Lorenz, M.J. Richter, K. Tello, H. Gall, H.A. Ghofrani, E. Mayer, C.B. Wiedenroth, S. Guth, H. Lorchner, J. Poling, P. Chelladurai, S.S. Pullamsetti, T. Braun, W. Seeger, C.W. Hamm, and H. Nef, CILP1 as a biomarker for right ventricular maladaptation in pulmonary hypertension. Eur Respir J, 2021. 57(4).
- Hobohm, L., S. Kolmel, C. Niemann, P. Kumpers, V.J. Krieg, M.L. Bochenek, A.H. Lukasz, Y. Reiss, K.H. Plate, C. Liebetrau, C.B. Wiedenroth, S. Guth, T. Munzel, G. Hasenfuss, P. Wenzel, E. Mayer, S.V. Konstantinides, K. Schafer, and M. Lankeit, Role of angiopoietin-2 in venous thrombus resolution and chronic thromboembolic disease. Eur Respir J, 2021.
- Ghofrani, H.A., A.M. D'Armini, N.H. Kim, E. Mayer, and G. Simonneau, Interventional and pharmacological management of chronic thromboembolic pulmonary hypertension. Respir Med, 2021. 177: p. 106293.
- Wiedenroth Md, C.B., A.J. Rieth Md, S. Kriechbaum Md, H.A. Ghofrani Md, A. Breithecker Md, M. Haas Md, F. Roller Md, M.J. Richter Md, M. Lankeit, L. Mielzarek, A. Rolf Md, C.W. Hamm Md, E. Mayer Md, S. Guth Md, and C. Liebetrau Md, Exercise right heart catheterization before and after balloon pulmonary angioplasty in inoperable patients with chronic thromboembolic pulmonary hypertension. Pulm Circ, 2020. 10(3): p. 2045894020917884.
- Nagel, C., M. Nasereddin, N. Benjamin, B. Egenlauf, S. Harutyunova, C.A. Eichstaedt, P. Xanthouli, E. Mayer, E. Grunig, and S. Guth, Supervised Exercise Training in Patients with Chronic Thromboembolic Pulmonary Hypertension as Early Follow-Up Treatment after Pulmonary Endarterectomy: A Prospective Cohort Study. Respiration, 2020. 99(7): p. 577-588.
- Krieg, V.J., L. Hobohm, C. Liebetrau, S. Guth, S. Kolmel, C. Troidl, E. Mayer, S.V. Konstantinides, C.B. Wiedenroth, and M. Lankeit, Risk factors for chronic thromboembolic pulmonary hypertension - Importance of thyroid disease and function. Thromb Res, 2020. 185: p. 20-26.
- Kriechbaum, S.D., C.B. Wiedenroth, K. Peters, M.A. Barde, R. Ajnwojner, J.S. Wolter, M. Haas, F.C. Roller, S. Guth, A.J. Rieth, A. Rolf, C.W. Hamm, E. Mayer, T. Keller, and C. Liebetrau, Galectin-3, GDF-15, and sST2 for the assessment of disease severity and therapy response in patients suffering from inoperable chronic thromboembolic pulmonary hypertension. Biomarkers, 2020. 25(7): p. 578-586.
- Kriechbaum, S.D., L. Scherwitz, C.B. Wiedenroth, F. Rudolph, J.S. Wolter, M. Haas, U. Fischer-Rasokat, A. Rolf, C.W. Hamm, E. Mayer, S. Guth, T. Keller, S.V. Konstantinides, M. Lankeit, and C. Liebetrau, Mid-regional pro-atrial natriuretic peptide and copeptin as indicators of disease severity and therapy response in CTEPH. ERJ Open Res, 2020. 6(4).
- Kriechbaum, S.D., F. Rudolph, C.B. Wiedenroth, L. Mielzarek, M. Haas, S. Guth, C.W. Hamm, E. Mayer, C. Liebetrau, and T. Keller, Pregnancy-associated plasma protein A - a new indicator of pulmonary vascular remodeling in chronic thromboembolic pulmonary hypertension? Respir Res, 2020. 21(1): p. 204.
- Keranov, S., O. Dorr, L. Jafari, C. Troidl, C. Liebetrau, S. Kriechbaum, T. Keller, S. Voss, T. Bauer, J. Lorenz, M.J. Richter, K. Tello, H. Gall, H.A. Ghofrani, E. Mayer, C.B. Wiedenroth, S. Guth, H. Lorchner, J. Poling, P. Chelladurai, S.S. Pullamsetti, T. Braun, W. Seeger, C.W. Hamm, and H. Nef, CILP1 as a biomarker for right ventricular maladaptation in pulmonary hypertension. Eur Respir J, 2020.
- Keranov, S., O. Dorr, L. Jafari, C. Liebetrau, T. Keller, C. Troidl, S. Kriechbaum, S. Voss, M. Richter, K. Tello, H. Gall, H.A. Ghofrani, E. Mayer, W. Seeger, C.W. Hamm, and H. Nef, SPARCL1 as a biomarker of maladaptive right ventricular remodelling in pulmonary hypertension. Biomarkers, 2020. 25(3): p. 290-295.
- Eichstaedt, C.A., J. Verweyen, M. Halank, N. Benjamin, C. Fischer, E. Mayer, S. Guth, C.B. Wiedenroth, B. Egenlauf, S. Harutyunova, P. Xanthouli, A.M. Marra, H. Wilkens, R. Ewert, K. Hinderhofer, and E. Grunig, Myeloproliferative Diseases as Possible Risk Factor for Development of Chronic Thromboembolic Pulmonary Hypertension-A Genetic Study. Int J Mol Sci, 2020. 21(9).
- Delcroix, M., A. Torbicki, D. Gopalan, O. Sitbon, F.A. Klok, I. Lang, D. Jenkins, N.H. Kim, M. Humbert, X. Jais, A.V. Noordegraaf, J. Pepke-Zaba, P. Brenot, P. Dorfmuller, E. Fadel, H.A. Ghofrani, M.M. Hoeper, P. Jansa, M. Madani, H. Matsubara, T. Ogo, E. Grunig, A. D'Armini, N. Galie, B. Meyer, P. Corkery, G. Meszaros, E. Mayer, and G. Simonneau, ERS Statement on Chronic Thromboembolic Pulmonary Hypertension. Eur Respir J, 2020.
- Bochenek, M.L., C. Leidinger, N.S. Rosinus, R. Gogiraju, S. Guth, L. Hobohm, K. Jurk, E. Mayer, T. Munzel, M. Lankeit, M. Bosmann, S. Konstantinides, and K. Schafer, Activated Endothelial TGFbeta1 Signaling Promotes Venous Thrombus Nonresolution in Mice Via Endothelin-1: Potential Role for Chronic Thromboembolic Pulmonary Hypertension. Circ Res, 2020. 126(2): p. 162-181.
- Barco, S., F.A. Klok, S.V. Konstantinides, P. Dartevelle, E. Fadel, D. Jenkins, N.H. Kim, M. Madani, H. Matsubara, E. Mayer, J. Pepke-Zaba, G. Simonneau, M. Delcroix, and I.M. Lang, Sex-specific differences in chronic thromboembolic pulmonary hypertension. Results from the European CTEPH registry. J Thromb Haemost, 2020. 18(1): p. 151-161.
Alle Publikationen Thoraxchirurgie bis Mai 2021 finden Sie hier >>
Publikationsberichte Kerckhoff-Klink >>